26.05. ТЕМА. Повторення. Розрахункові
задачі №10: «Розрахунки за хімічними
рівняннями маси, об'єму, кількості речовини реагентів та продуктів реакцій»
Обчислення масу реагенту за масою іншого реагенту.
Дано:
m( Н2О)
= 55г Розв’язання
1)
 Записуємо
рівняння реакції купрум оксиду з
Записуємо
рівняння реакції купрум оксиду з
m(CаO)
– ? водою
CаO+ H2O = Cа(OH)2↓
2)
Обчислюємо значення молярних мас
речовин, що вступили в реакцію:
M(CаO) = 40 + 16 =
56г/моль;
M(H2O ) = 1*2 +16 = 18 г/моль.
3)
Запишемо маси й відповідні дані,
використовуючи рівняння реакції:
Х г 55 г
CuO + H2O =Cu(OH)2↓
М=56
г/моль М=18 г/моль
m=56 г m= 18 г
4) Підписавши
значення мас під формулами речовин, за якими будемо виконувати обчислення, а
невідомі – над формулами, складаємо пропорцію:
5) Обчислюємо
невідоме, позначене х:
х=385 г
Відповідь: у
реакцію вступить 385 г CаO
Задача. Внаслідок взаємодії ферум (ІІ) оксиду з хлоридною
кислотою утворився ферум (ІІ) хлорид масою 12,7 г. Обчисліть масу ферум (ІІ)
оксиду, що вступив в реакцію.
m ( FeCl2 ) = 12,7 г х г 12,7 г
m (
FeO ) – ? 1 моль1 моль
М= 72 г/моль М= 127 г/моль
m= 72 г
m= 127 г
х= 7,2 г
Відповідь: m ( FeO ) = 7,2 г
Задача. Через
розчин, що містив натрій гідроксид масою 4 г, пропустили карбон(IV) оксид до
утворення натрій карбонату. Обчисліть об’єм карбон(IV) оксиду та масу
утвореного продукту.
ЗАВДАННЯ: записати приклади задач та розв'язати останню задачу за зразками.
28.05. ТЕМА. Екскурсія Краєзнавчий музей.
Завдання: зайти за посиланням, переглянути матеріал, написати 5 речень вражень від побаченого.
19.05. ТЕМА. Повторення. Генетичні
зв’язки між основними класами неорганічних сполук.
ЗАВДАННЯ: виконати творче завдання з відео, підібравши певний метал(вибір), фото на вайбер.
21.05. ТЕМА. Хімічні властивості оксидів, кислот, основ і середніх солей.
Завдання: зробити ментальну карту хімічних властивостей (на вибір: оксидів, кислот, основ, солей), &27(оксиди), 29(основи), 30(кислоти), 32(солі)- фото на вайбер
12.05. Тема. Систематизація, аналіз та коригування знань учнів.
1. Чому
оксигеновмісні кислоти, й основи належать до класу гідроксидів? Відповідь поясніть.
2. Як змінюються хімічні властивості
манган оксидів у ряду:
MnO, MnO2, Mn2O7? Зробіть висновок.
3. Білий осад розчиняється в нітратній
кислоті та розчині натрій гідроксиду. Яка речовина міститься в осаді? Відповідь
підтвердьте рівняннями реакцій.
4. 3 хімічних елементів К, S, О, Н, С, Р, А1,СІ, Са, Zn складіть можливі формули складних речовин і назвіть
їх:
а) оксиди; б) кислоти;
в) основи; г) солі.
5. Які з речовин —
Sі02, Н2S04, NaOH, СuSO4 — будуть
реагувати:
а) з лугами; б) з нерозчинними основами;
в) з розчинними солями; г) з нерозчинними солями.
Напишіть рівняння хімічних
реакцій.
6. Як добути кальцій хлорид з кальцій
нітрату, використовуючи карбонат і
хлоридну кислоту? Напишіть рівняння реакцій.
7. Знайдіть ряд, у якому всі речовини
реагують з калій гідроксидом:
а)
НNO3, SO3, Са(ОН)2,
СаС03
б)
А1203, С02, СuС12 ;Zn(OH)2
в) FеС13,
ВаО, Н2S04, НС1;
г) ZnО; ВеО, Р205.
А1(ОН)3,.
Відповідь
підтвердьте рівняннями реакцій.
8. Під час взаємодії яких речовин могли
утворитися такі продукти
реакції:
?+? = Ва(N03)2+Н20 ;
?+?= Са(ОН)2,
?+? = N аСІ + Н20+С02
?+?
= А1(ОН3)+КNO3;
?+?
= СаС03;
?+?=
АgСІ+HN03;
?+?
= Н3 Р04;
?+?
= ZnSO4+Сu?
Допишіть рівняння,
розставте коефіцієнти.
9. Допишіть
рівняння реакций і поясніть, чому деякі з реакцій неможливі:
Cu + ZnSO4 =
CaCO3 + HCI =
NaCI + AgNO3
=
BaSO4 + KNO3 =
10.Напишіть рівняння реакцій, за допомогою
яких можна здійснити наступні перетворення:
Mg → MgO → MgCI2 → MgCO3
→ Mg(NO3)2
11. Під час термічного розкладу кальцій
карбонату утворилося 1,4 г
кальцій оксиду. Яка маса кальцій карбонату піддалася розкладу?
12. 3 фосфор (V) оксидом прореагувала вода
масою 27 г .
Якою є маса ортофосфатної кислоти, що утворилася?
13. Обчисліть масу фосфору, яку необхідно ввести у низку
перетворень для добуваний кальцій фосфату масою 15,5 г .
Завдання: виконати 6 завдань на вибір (9-10 балів), 5 (7-8 балів), 4 (5-6 балів), 3 (1-4 бали).
14.05. Тема. Повторення. Ковалентний та йонний зв'язки, їх утворення.
Завдання: записати схеми ковалентного та йонного зв'язку
05.05. Тема. Представлення результатів навчальних
проєктів
№7 «Неорганічні речовини –
представники основних класів у будівництві й побуті.» - Буличов С.
№8 «Хімічний склад і використання мінералів.» - Гринь М.
№9
«Вплив
хімічних сполук на довкілля і здоров’я людини.» - Наумік Є.
Презентацію надсилайте на galizkaj@gmail.com , фото постерів, плакатів на вайбер в особисті повідомлення.
07.05. Тема. Контрольна робота №2 з теми "Основні класи неорганічних сполук"
Система оцінювання:
Завдання
1-4 – тестові, кожне завдання
оцінюється по 0,5 бала, у сумі перші 4 завдань – 2 бал;
Завдання
5-6 оцінюються по 1,5 балу, разом
за 6 правильно виконаних завдань - 5 балів;
Завдання
7-8 оцінюються по 2 бали, разом
за 8
правильно виконаних завдань -9 балів;
Завдання 9 пропонується виконувати учням,
які претендують на оцінку 12 балів, оцінюється в 3 бали.
Таким чином, максимальна оцінка за
правильно виконану роботу становить 12 балів.
Час виконання роботи – 40 хвилин.
Попередження роботи на подвійних листах в клітинку. Фото роботи здати до 12.00.на вайбер. Після 12.00 завдання вилучаються з блогу. Зверніть увагу, варіанти визначені
8 кл. «Основні класи неорганічних сполук» І варіант(Буличов, Саржевський, Дончик)
І рівень( 4 бали)
1. Вкажіть ряд речовин, в якому наведено тільки оксиди:
А) K2SO4, MgO, Fe2O3;
|
Б) Al2O3, SiO2, HNO3;
|
В) SO2, SO3, CO2;
|
Г) N2O, CO, Ca(OH)2
|
2. Позначте формулу оксиду, в якому Нітроген виявляє валентність ІІІ:
А) NO;
|
Б) N2O3;
|
В) NO2;
|
Г) N2O5
|
3. Вкажіть ряд, в якому наведено тільки оксигеновмісні кислоти:
А) сульфатна, нітратна, хлоридна;
|
Б) флуоридна, сульфідна, бромідна;
|
В) сульфітна, фосфатна, силікатна;
|
Г) нітритна, сульфідна, фосфітна;
|
4. Позначте формулу кальцій сульфату:
А) Ca(SO4)2;
|
Б) Ca2SO4 ;
|
В) CaSO4;
|
Г) K2SO4
|
5. Позначте назву основи:
А) калій хлорид;
|
Б) натрій гідроксид;
|
В) алюміній сульфат;
|
Г) магній оксид
|
6. Позначте назву речовини, що має формулу H3PO4:
А)фосфор гідрат
|
Б) фосфор гідрат;
|
В) гідроген фосфід;
|
Г)ортофосфатна к-та;
|
7. Позначте формули солей:
А) HCl;
|
Б) H2SO4;
|
В) NaOH;
|
Г) KCl;
|
Д) Na2SO4;
|
Е) AlI3
|
8. Позначте
правильні твердження про кислоти:
А) всі кислоти містять у своєму складі Оксиген;
|
Г) до складу
молекули кислоти входить тільки один атом Гідрогену;
|
|
Б) більшість кислот використовують у вигляді розчинів;
|
В) всі кислоти
солодкі на смак;
|
ІІ рівень( 3 бала)
9. Встановіть
відповідність між назвою речовини та її хімічною формулою:
Назва речовини
|
Формула
|
А
|
Б
|
В
|
Г
|
Д
|
|
1.сульфатна кислота;
|
A.K2SO3;
|
1
|
|||||
2. сульфітна кислота;
|
Б. H2SO4;
|
2
|
|||||
3. калій силікат;
|
В. K2SO4;
|
3
|
|||||
4. калій сульфат;
|
Г. K2SiO3;
|
4
|
|||||
Д. H2SO3
|
Формула
|
|
A.NaHSO3;
|
|
Б. Cu(OH)2;
|
|
В. H2S;
|
|
Г. N2O;
|
|
Д. Al2O3
|
11. Встановіть
відповідність між класом речовини та її хімічною формулою:
Назва речовини
|
Формула
|
А
|
Б
|
В
|
Г
|
Д
|
|
1. нерозчинна основа
|
A.Fe (OH)3;
|
1
|
|||||
2. кислота;
|
Б. LiOH
|
2
|
|||||
3. кислотний оксид;
|
В. K2HPO4;
|
3
|
|||||
4. сіль
|
Г. Cl2O7;
|
4
|
|||||
5.луг
|
Д. H2SeO4;
|
5
|
ІІІ рівень( 3 бала)
12.Допишіть
схеми реакцій і складіть рівняння:
а) SO3 + Mg(OH)2 →
б) BaCl2 + H2SO4→
в) Fe(OH)3 t
г) Na2O + H2O →
13.Здійснити
перетворення:
S → SO3 → H2SO4 →CaSO4→ CaCl2
↓
K2SO4
ІV рівень ( 2 бала)
14.Розведена сульфатна
кислота прореагувала із магнієм, масою 5,8 г. Обчислити масу утвореної солі і
об’єм водню, що виділився за нормальних умов.
8 кл. «Основні класи неорганічних сполук» ІI варіант (Наумік, Марич, Гринь )
І рівень( 4 бали)
1. Вкажіть ряд речовин, в якому наведено тільки гідроксиди:
А) K2SO4,
MgO, Fe2O3;
|
Б) Al(OH)3, KOH;
|
В) SO2,
SO3, CO2;
|
Г) N2O,
CO, Ca(OH)2
|
2. Позначте формулу оксиду, в якому Нітроген виявляє валентність V:
А) N2O3;
|
Б) NO2;
|
В) NO;
|
Г) N2O5
|
3. Вкажіть ряд, в якому наведено тільки безоксигенові кислоти:
А) флуоридна, сульфідна, бромідна;
|
Б) сульфітна, фосфатна, силікатна;
|
В) нітритна, сульфідна, фосфітна;
|
Г) сульфатна, нітратна, хлоридна
|
4. Позначте формулу калій сульфату:
А) K2SO3;
|
Б) CaSO4;
|
В) Ca(SO4)2;
|
Г) K2SO4
|
5. Позначте назву кислоти:
А)натрій гідроксид;
|
Б) калій хлорид;
|
В) хлорид на кислота;
|
Г) алюміній сульфат
|
6. Позначте назву речовини, що має формулу NaOH:
А)натрій оксогідрат
|
Б) натрій гідроксид;
|
В) натрій фосфід;
|
Г) натрій гідрид
|
7. Позначте формули кислот:
А) H2SO4;
|
Б) NaOH;
|
В) AlI3
|
Г) Na2SO4;
|
Д) HCl;
|
Е) KCl;
|
8. Позначте
правильні твердження про гідроксиди:
А) всі гідроксиди білого кольору
|
Г) до складу входять
тільки атоми металу;
|
Б) більшість гідроксидів розчинні у воді
|
В) всі луги
милкі на дотик;
|
ІІ рівень( 3 бали)
9. Встановіть
відповідність між назвою речовини та її хімічною формулою:
Назва речовини
|
Формула
|
А
|
Б
|
В
|
Г
|
Д
|
|
1.сульфатна кислота;
|
A.K2SO3;
|
1
|
|||||
2. калій сульфіт;
|
Б. H2SO4;
|
2
|
|||||
3. калій гідроксид;
|
В. KОН
|
3
|
|||||
4. сульфідна кислота;
|
Г. K2SiO3;
|
4
|
|||||
Д. H2SO3
|
Формула
|
|
A.Ca(HCO3)2;
|
|
Б. Ва(OH)2;
|
|
В. H2AsO4;
|
|
Г. СO;
|
|
Д. Fe2O3
|
11. Встановіть
відповідність між класом речовини та її хімічною формулою:
Назва речовини
|
Формула
|
А
|
Б
|
В
|
Г
|
Д
|
|
1. нерозчинна основа
|
A. Ca(OH)2
|
1
|
|||||
2. кислота;
|
Б. H2TeO4
|
2
|
|||||
3. кислотний оксид;
|
В. Na2HPO4;
|
3
|
|||||
4. сіль
|
Г. CO2;
|
4
|
|||||
5.луг
|
Д. Cr (OH)3;
|
5
|
ІІІ рівень( 3 бала)
12.Допишіть
схеми реакцій і складіть рівняння:
а) CO2 + Ca(OH)2 →
б) PbSO4 + HCl→
в) Al(OH)3 t
г) BaO + H2O →
13.Здійснити
перетворення:
Na → Na2O → NaOH →Na2SO4→
NaCl
↓
Na2CO3
ІV рівень ( 2 бала)
14.Хлоридна кислота
прореагувала із кальцієм, масою 8,7 г. Обчислити масу утвореної солі і об’єм
водню, що виділився за нормальних умов.
28.04. Тема. Первинний інструктаж з БЖ Практична робота №3: «Розв’язування
експериментальних задач.»
Тема. Практична робота №3 Розв’язування
експериментальних задач.
Мета:вдосконалювати набуті знання про електролітичну
дисоціацію та реакції у розчинах електролітів;продовжувати формувати вміння
записувати повні й скорочені йонні рівняння, розв'язувати
експериментальні задачі, робити висновки; виховувати працьовитість, посидючість, відповідальність за результат роботу.
Обладнання: відео матеріал до практичної роботи №3
За відео оформити практичну роботу (всі задачі записати)
30.04. Тема. Розрахункові задачі №10: «Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів та продуктів реакцій.»
21.04. Тема. Генетичні зв’язки між основними класами неорганічних сполук.
Завдання необхідно виконати до 21 квітня 19:00
ЗАВДАННЯ: переглянь відео, &38 повторити.
23.04. Тема. Первинний інструктаж з БЖ. Практична робота №2: «Дослідження властивостей основних класів
неорганічних сполук.»
Мета: поглибити знання про хімічні властивості
оксидів, кислот, основ і солей.
Обладнання : відео дослідів, зошит, підручник.
Хід роботи
Первинний інструктаж з БЖ.
Дослід 1. Взаємодія хлориної кислоти з ферум(III) оксидом.
Ø У пробірку насипте ферум (III) оксиду та додайте розчин хлоридної кислоти.
Ø Розчин обережно нагрійте над
пальником.
v Спостерігайте за зникненням
оксиду та зміною забарвлення розчину у пробірці.
Fe2O3 + HCl→ Закінчи реакцію
Дослід 2. Взаємодія купрум сульфату з натрій
гідроксидом.
Ø У пробірку налийте розчин купрум сульфату та додайте розчин натрій гідроксиду.
v Спостерігайте за появою
блакитного осаду у пробірці.
CuSO4+ NaOH→Закінчи реакцію
Дослід 3. Дослідіть взаємодію хлоридної кислоти та
найтрій гідроксиду (реакція нейтралізації).
Опис досліду.
Висновок:....
16.04. Тема. Генетичні зв’язки між основними класами неорганічних сполук.
ЗАВДАННЯ: переглянь відео та запиши схему ""Генетичний зв'язок між класами неорганічних сполук" &38 прочитати.
09.04. Хімічні властивості середніх солей
ЗАВДАННЯ. Параграф 32 повторити, с.181 №256 - написати нівняння реакцій (на вибір 2 букви)
07.04. Хімічні властивості середніх солей
1. Взаємодія розчинів солей із металами.
Працями М. Бекетова доведено, що метали проявляють різну хімічну активність. Тому в реакціях між металом і сіллю тільки активніший метал витіснить менш активний. Наприклад, якщо мідну монету покласти в розчин меркурій (II) нітрату, вона поступово покривається шаром ртуті, а мідь переходить в розчин:
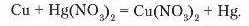
Дослідимо взаємодію солей з металами у процесі лабораторного досліду. Віртуальний дослід.
ВЗАЄМОДІЯ МЕТАЛІВ ІЗ СОЛЯМИ У ВОДНОМУ РОЗЧИНІ
Порівнявши активність металів, що вступають у реакцію, і тих, які входять до складу солей, можна зробити висновок: реакція відбувається тоді, коли метал є більш активним за той, що входить до складу солі.
Рівняння реакцій:
Fe + CuSO4 = FeSO4 + Cu ;
Zn + CuSO4 = ZnSO4 + Cu
Zn +SnCl2 = ZnCl2 + Sn;
Zn + Pb(NO3)2 = Zn(NO3)2 + Pb
2. Взаємодія солей з кислотами
Водні розчини солей реагують з кислотами, унаслідок чого утворюється нова сіль і нова кислота. Якщо до розчину нагрій
карбонату долити хлоридпої кислоти, то відбувається бурхливе виділення газу. Це свідчить проте, що реакція відбулася.
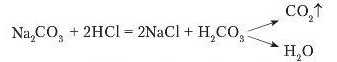
Однак не тільки карбонати взаємодіють з кислотами з виділенням газу. Під час доливання до розчину калій сульфіту нітратної кислоти теж спостерігається виділення газу. Це сульфур(ІУ) оксид.
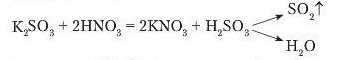
Як вам відомо, реакції відоуваються, коли під час їх перебігу випадає осад. Візьмемо розчин барій хлориду й подіємо розчином сульфатної кислоти. Спостерігається випадання білого осаду.
BaCl2 + H2SO4 =BaSO4 + 2HCl
Вам уже відома реакція між аргентум нітратом і хлоридною кислотою. Під час цієї реакції випадає білий сирнистий осад.
AgNO3 + HCl = AgCl +HNO3
Отже, зробимо висновок про взаємодію розчинів солей з кислотами. Реакції між солями й кислотами в розчинах відбуваються за умови, якщо:
1) утворюється нова сіль і нова кислота. Нова кислота є нестійкою та розкладається на відповідний їй оксид і воду. У результаті реакції виділяється газ;
2) випадає нерозчинний у кислотах осад.
3. Взаємодія солей із лугами.
Напишіть самостійно рівняння реакцій взаємодії цинк сульфату, плюмбум(ІІ) хлориду, ферум(ІІІ) нітрату з натрій гідроксидом.
Лабораторний дослід
ВЗАЄМОДІЯ СОЛЕЙ З ЛУГАМИ У ВОДНОМУ РОЗЧИНІ
Na2SO4+ Ba(OH)2 = BaSO4+ 2NaOH.
Утворюється білий осад барій сульфату. Якщо до останнього долити кислоти, то осад не розчиняється.
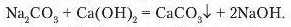
Знову ж таки випав білий осад, який за доливання кислоти розчиняється.
Інтерактивна вправа. Перегляньте відео Хімічні властивості солей
4. Взаємодія розчинів солей між собою.
Розчинні у воді солі вступають у реакції обміну.
Лабораторний дослід. РЕАКЦІЯ ОБМІНУ МІЖ СОЛЯМИ В РОЗЧИНІ
Рівняння реакцій:
AgNO3 + Na3PO4= Ag3PO4 + NaNO3
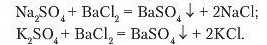
Зверніть увагу на те, що солі вступають у реакції обміну між собою тільки в розчинах.
ЗАВДАННЯ. Параграф 32 опрацювати, с.181 №255 -замість крапок написати формули солей і претворіть схеми реакцій на хімічні рівняння(на вибір а,б,в)
ЗАВДАННЯ. Параграф 32 опрацювати, с.181 №255 -замість крапок написати формули солей і претворіть схеми реакцій на хімічні рівняння(на вибір а,б,в)
Немає коментарів:
Дописати коментар